ABOUT NRMD
NRMDについて

ABOUT NRMDシームレスな開発フロー
日本再生医療学会は、「再生医療等データ登録システム(NRMD)」と呼ばれる大規模な臨床データ登録システムの構築に取り組んできました。
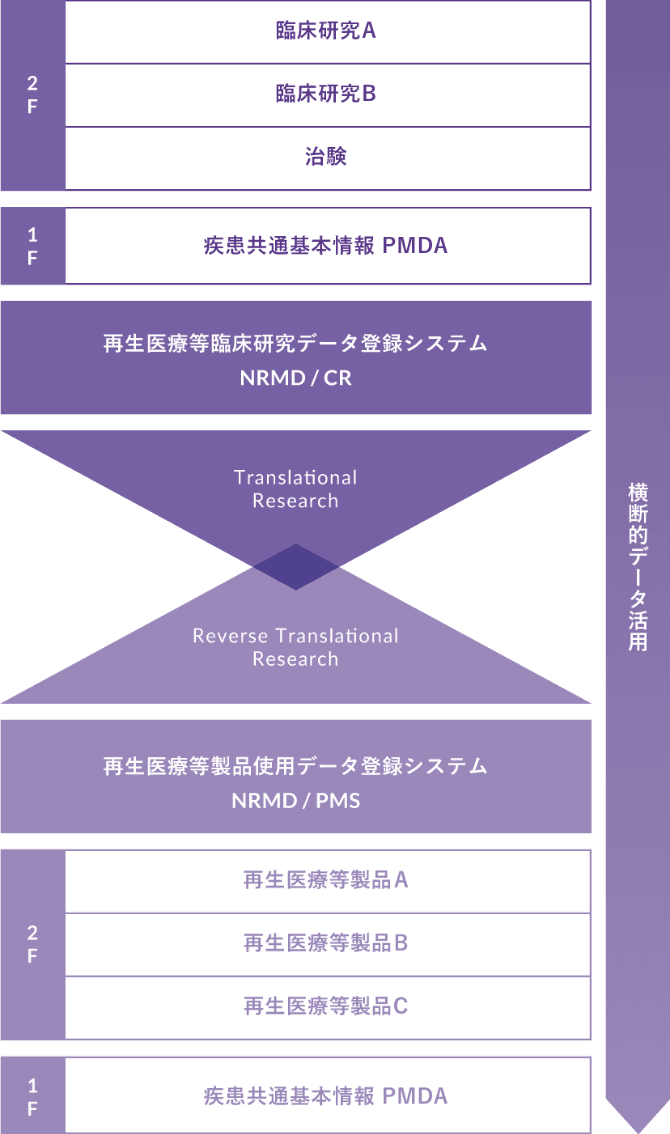
NRMDは、対象となるリアルワールドエビデンスを蓄積することにより、臨床研究から製造販売後調査等までのシームレスなトランスレーショナルリサーチ/リバーストランスレーショナルリサーチを可能にし、それらの安全性と有効性を評価するデータを提供します。
rTR…リバーストランスレーションリサーチ
FEAUTURENRMDの特長

POINT 01官民一体連携運用のNRMDは、再生医療の安全・着実・迅速な開発を支援します。
再生医療等製品の承認制度が改正
NRMDは、PMDAと共同で開発し、日本医学会との協力により運営される官民一体型のデータベースです。
平成26年11月に施行された医薬品医療機器等法において再生医療等製品の早期実用化に対応した承認制度が改正されました。これにより再生医療等製品は、有効性が推定され、安全性が認められれば、特別に早期に、条件および期限を付して承認(条件・期限付承認)を受けられるようになり、早期実用化への可能性が拡がりました。
製造販売後調査等のデータ収集、評価が重要
この条件・期限付承認制度では、一定数の限られた症例から短期間で有効性を推定し、急性期の副作用等は短期間で安全性の評価を行うことができます。
しかし、製品の不均質性、製造能力、適用患者数などの理由から、臨床データの収集・評価には制限があります。このため、関連学会などと連携し、製造販売後調査等の確かな安全計画の設計と着実な情報の収集・評価が求められています。
厚労省によりNRMDを用いた研究開発モデルが提唱
このような背景があり厚生労働省では、市販後の情報を着実に収集・評価するため、日本再生医療学会のNRMDを活用した再生医療等製品の研究開発モデルが提唱され、厚生労働省医薬・生活衛生局医薬安全対策課長通知により再生医療等製品の製造販売後調査等での使用が依頼されています。
(平成29年9月28日薬生安発0928第1号)

POINT 02NRMDは、臨床研究と製造販売後調査等のための法規制要件や実施基準を満たす高品質なシステムを提供します。
規格への非準拠による産学の分離
日本の医薬品医療機器等法および関連規制によると、再生医療等製品の薬事申請に関する臨床データはGPSP等の規格に準拠することとされています。しかし、ほとんどの公的なレジストリはこれらの規格と互換性がなく、多くの臨床データを薬事に適用することは出来ません。これはアカデミアと産業との間の分離を引き起こし、学術的試みから得られたデータは学術目的でのみ使用されてきました。
日米欧の法規制上の要件や実施基準に対応
NRMDには臨床研究(治験を含む)での臨床成績評価を担うNRMD/CRと、薬事開発での製造販売後調査等フェーズを担うNRMD/PMSの2つのデータベースがあります。両データベースを一元管理することにより横断的データ活用が可能となりトランスレーショナルリサーチ、リバーストランスレーショナルリサーチにも活用することができます。また、GPSP省令、CSVに完全対応し、PMDA・ICH・FDA・EMA等により定められた日米欧三極の臨床研究のための法規制上の要件や実施基準をみたしています。






