About NRMD

ABOUT NRMDSeamless Development Flow
日本再生医療学会は、「再生医療等データ登録システム(NRMD)」と呼ばれる大規模な臨床データ登録システムの構築に取り組んできました。
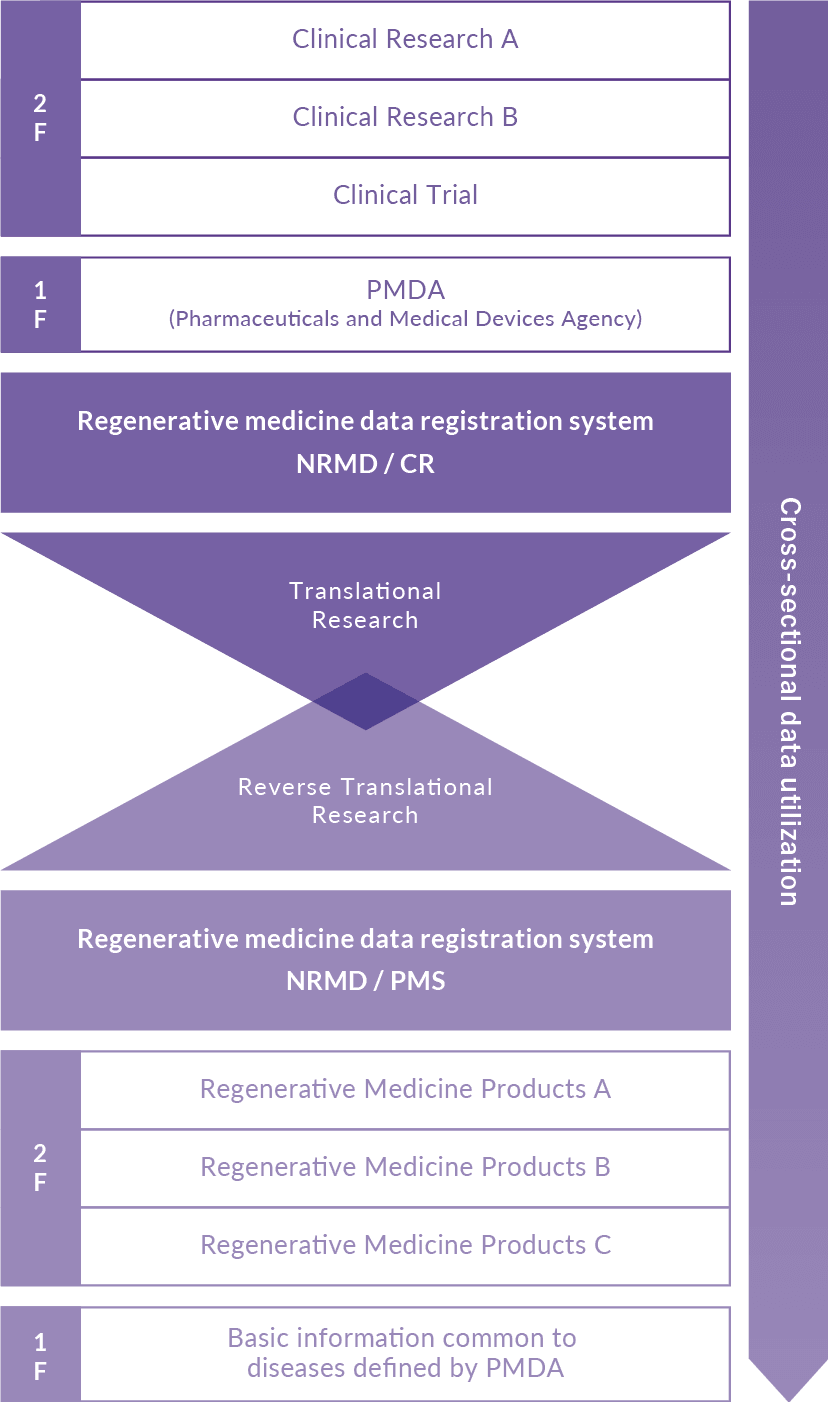
NRMDは、対象となるリアルワールドエビデンスを蓄積することにより、臨床研究から製造販売後調査等までのシームレスなトランスレーショナルリサーチ/リバーストランスレーショナルリサーチを可能にし、それらの安全性と有効性を評価するデータを提供します。
rTR=reverse translational research
FEAUTURECharacteristics

POINT 01Operated as a public-private sector collaboration, the NRMD supports the safe, steady, and speedy development of regenerative medicine.
Revision to the authorization system for regenerative medicine products
NRMD is an integrated public-private sector database developed jointly with PMDA and operated with the cooperation of The Japanese Association of Medical Sciences. The Pharmaceuticals and Medical Devices Act (PMD Act) enacted in November 2014 revised the authorization system for regenerative medical and related products in order to achieve rapid practical application. Under this system, the efficacy of regenerative medical or related products is estimated and if their safety is recognized, products are granted special, rapid authorization with conditions and a time limit attached (conditional/time-limited authorization), widening the possibility for accelerated practical application.
製造販売後調査等のデータ収集、評価が重要
この条件・期限付承認制度では、一定数の限られた症例から短期間で有効性を推定し、急性期の副作用等は短期間で安全性の評価を行うことができます。
しかし、製品の不均質性、製造能力、適用患者数などの理由から、臨床データの収集・評価には制限があります。このため、関連学会などと連携し、製造販売後調査等の確かな安全計画の設計と着実な情報の収集・評価が求められています。
MHLW advocates R&D models that utilize NRMD
このような背景があり厚生労働省では、市販後の情報を着実に収集・評価するため、日本再生医療学会のNRMDを活用した再生医療等製品の研究開発モデルが提唱され、厚生労働省医薬・生活衛生局医薬安全対策課長通知により再生医療等製品の製造販売後調査等での使用が依頼されています。
(PSEHB/PSD Notification No. 0928-1, September 28, 2017)

POINT 02NRMDは、臨床研究と製造販売後調査等のための法規制要件や実施基準を満たす高品質なシステムを提供します。
Incompatible standards leading to divide between industry and academia
Japan's PMD Act and related laws require clinical data for pharmaceutical applications related to regenerative medicine and related products to comply with Good Post-marketing Study Practice (GPSP) and other standards. However, most public registries are not compatible with these standards, disqualifying a large amount of clinical data from being used in pharmaceutical applications. This has created a division between academia and industry, meaning that data gathered through academic endeavours is only used for academic purposes.
Compliant with Japanese/U.S./European regulatory requirements and practical standards
NRMDには臨床研究(治験を含む)での臨床成績評価を担うNRMD/CRと、薬事開発での製造販売後調査等フェーズを担うNRMD/PMSの2つのデータベースがあります。両データベースを一元管理することにより横断的データ活用が可能となりトランスレーショナルリサーチ、リバーストランスレーショナルリサーチにも活用することができます。また、GPSP省令、CSVに完全対応し、PMDA・ICH・FDA・EMA等により定められた日米欧三極の臨床研究のための法規制上の要件や実施基準をみたしています。
CONTACT USCONTACT
The Japanese Society for Regenerative Medicine Database Committee aims to further develop and improve the NRMD based on user feedback. We welcome any inquiries or opinions - if you wish to use the database or have any questions, please contact us.






